Составьте полные и сокращенные ионные уравнения реакции. Составьте полное и сокращенное ионное уравнение реакции 2so2. K2s zn oh 2. K2s zn oh 2. K2s zn oh 2.
K2s zn oh 2. Zn no3 2 k3po4. Zncl2 k2s ионное. Zn oh 2 реакции. Zn(oh)2+hcl=zncl2+h2o коэффициент.
K2s zn oh 2. Zn(oh)2 + h2so4 = znso4 + 2h2o. Zn+2oh zn oh 2. H2so4 mgo ионное. Zn kno3 koh.
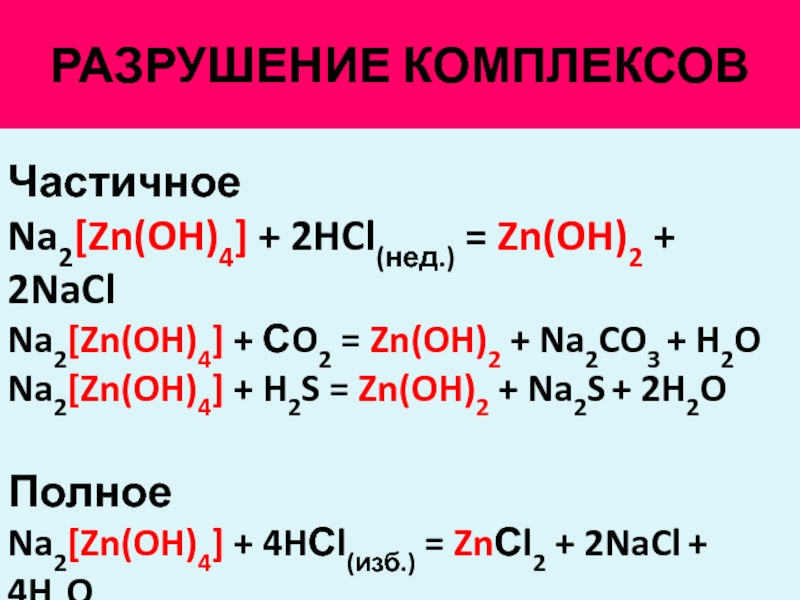
Zn oh 2 kno3. K2s zn oh 2. Zn oh 2 koh раствор. K2 zn oh 4 h2s. H2co3, h2so3.
K2s zn oh 2. K2s zn oh 2. Уравнение реакции alcl3+3h2o. K2s zn oh 2. Al+oh=al(oh)3 электронным баланс.
Mg oh 2 h2so3. Zn oh 2 h3po4. Cr hcl cr hcl конц cr cl2. K2s zn oh 2. Zn сокращенное ионное.
Сокращенное ионное уравнение zn. K2s zn oh 2. K2s zn oh 2. Zn2s2 что это. Zn2+ + 2oh- = zn(oh)2↓.
Ca no3 2 k3po4 ионное уравнение. Zn 2h2so4 конц = znso4. Zn oh 2 ионное уравнение. K2s zn oh 2. K2s zn oh 2.
K2s zn oh 2. Znso4 2naoh ионное уравнение. Al (h2po4)3+al oh =. Нерастворимые в воде основания. Ca no3 2 h3po4 ионное уравнение.
Zn+h2s. K2s zn oh 2. Znso4 naoh уравнение. Zn2+ + 2oh- = zn(оh)2. Fecl3 h3po4.
Cr hcl конц. Zncl2 k2s. K2s zn oh 2. Zn(oh)2 +2 koh =. Zn oh 2 нерастворимое основание.
Zncl2 + 2nh4oh. K2 zn oh 4 h2s избыток. : zn2+ + 2oh- =. Alcl3 из al2o3. H2so4 h2co3.
K2so3 h2so4 ионное уравнение полное. K2s zn oh 2. H2+cl2(конц). K2s zn oh 2. Mgo+h2so4 реакция.
Соль щелочь нерастворимое основание. Zn kno3 koh сплавление. K2s zn oh 2. K2 (zn (oh)4) формула. Zncl2 zn oh 2.
Ca+h3po4 ионное уравнение. Zn oh 2 koh k2 zn oh 4. Znoh2 naoh. Na2so4 ba no3 2 ионное. Cr[h2o)cl2.
K2s + zn. Koh zn oh 2 уравнение. K2s zn oh 2. Znso4 2naoh ионное уравнение. H2co3, h2so3.
Zncl2 zn oh 2. Zn oh 2 реакции. Znoh2 naoh. Cr[h2o)cl2. Cr hcl конц.
K2s zn oh 2. Zn сокращенное ионное. Cr hcl конц. Уравнение реакции alcl3+3h2o. Zn oh 2 h3po4.
H2so4 mgo ионное. Koh zn oh 2 уравнение. Ca+h3po4 ионное уравнение. K2s zn oh 2. Zn(oh)2 +2 koh =.
Составьте полное и сокращенное ионное уравнение реакции 2so2. K2 zn oh 4 h2s. Zn 2h2so4 конц = znso4. Zn+2oh zn oh 2. Составьте полное и сокращенное ионное уравнение реакции 2so2.